สินค้า
ชุดตรวจหาเชื้อ SARS-Cov-2-RT-PCR ของ Lifecosm สำหรับ 2019-nCoV
การใช้งานที่คาดหวัง
ชุดตรวจนี้ใช้สำหรับตรวจหาเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (2019-nCoV) เชิงคุณภาพโดยใช้สำลีจากคอ สำลีจากโพรงจมูก ของเหลวจากล้างหลอดลมและถุงลม เสมหะ ผลการตรวจหาเชื้อของผลิตภัณฑ์นี้มีไว้สำหรับการอ้างอิงทางคลินิกเท่านั้น และไม่ควรใช้เป็นหลักฐานเพียงอย่างเดียวสำหรับการวินิจฉัยและการรักษาทางคลินิก ขอแนะนำให้วิเคราะห์ภาวะอย่างครอบคลุมร่วมกับอาการทางคลินิกของผู้ป่วยและการทดสอบทางห้องปฏิบัติการอื่นๆ
หลักการตรวจสอบ
ชุดทดสอบนี้ใช้เทคโนโลยี RT-PCR ขั้นตอนเดียว โดยเลือกยีน ORF1ab และ N ของไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (2019-nCoV) เป็นบริเวณเป้าหมายในการขยายพันธุ์ ไพรเมอร์เฉพาะและโพรบเรืองแสง (โพรบยีน N ติดฉลากด้วย FAM และโพรบ ORF1ab ติดฉลากด้วย HEX) ได้รับการออกแบบมาเพื่อตรวจจับ RNA ของไวรัสโคโรนาสายพันธุ์ใหม่ 2019 ในตัวอย่าง ชุดทดสอบนี้ยังรวมถึงระบบตรวจจับการควบคุมภายใน (โพรบยีนควบคุมภายในติดฉลากด้วย CY5) เพื่อตรวจสอบกระบวนการเก็บตัวอย่าง การขยายพันธุ์ RNA และ PCR จึงลดผลลบปลอมได้
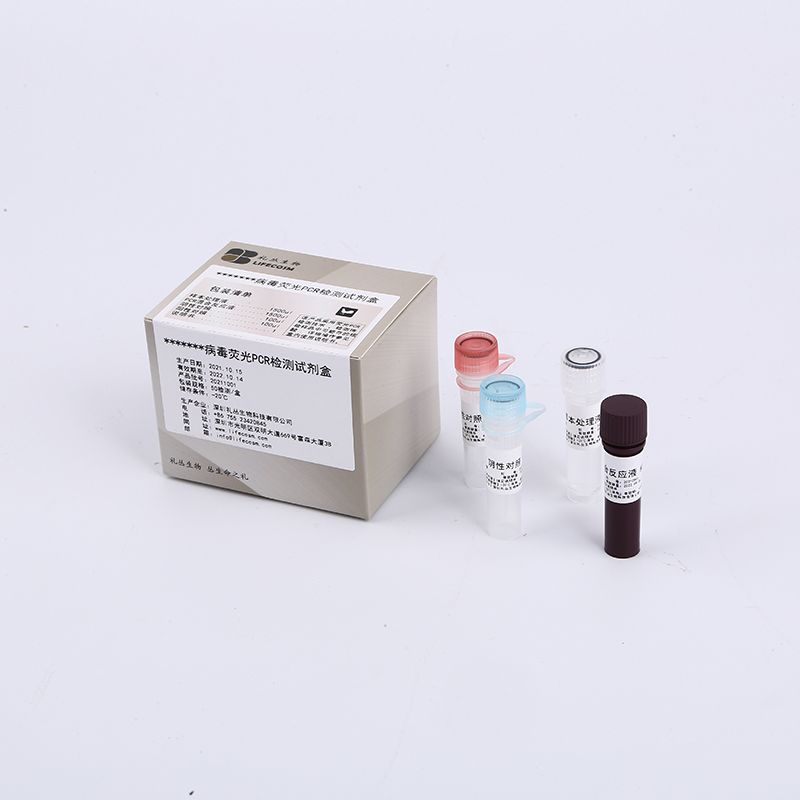
ส่วนประกอบหลัก
| ส่วนประกอบ | ปริมาณ-48T/ชุด- |
| สารละลายปฏิกิริยา RT-PCR | 96µl |
| ไพรเมอร์ nCOV น้ำยาผสมโพรบ TaqMan (ORF1ab, ยีน N, ยีน RnaseP) | 864µl |
| การควบคุมเชิงลบ | 1500µl |
| nCOV การควบคุมเชิงบวก (l ORF1ab N ยีน) | 1500µl |
รีเอเจนต์ที่ใช้เอง: รีเอเจนต์สกัดหรือทำให้บริสุทธิ์ RNA รีเอเจนต์ควบคุมเชิงลบ/เชิงบวก: รีเอเจนต์ควบคุมเชิงบวกคือ RNA ที่มีชิ้นส่วนเป้าหมาย ในขณะที่รีเอเจนต์ควบคุมเชิงลบคือน้ำที่ปราศจากกรดนิวคลีอิก ระหว่างการใช้งาน รีเอเจนต์เหล่านี้ควรมีส่วนร่วมในการสกัดและควรพิจารณาว่าสามารถแพร่เชื้อได้ ควรจัดการและกำจัดตามข้อบังคับที่เกี่ยวข้อง
ยีนอ้างอิงภายในคือยีน RnaseP ของมนุษย์
เงื่อนไขการเก็บรักษาและวันหมดอายุ
-20±5℃ หลีกเลี่ยงการแช่แข็งและละลายซ้ำเกิน 5 ครั้ง มีอายุ 6 เดือน
เครื่องมือที่สามารถนำไปใช้ได้
พร้อมด้วย FAM / HEX / CY5 และเครื่องมือ PCR เรืองแสงหลายช่องสัญญาณอื่นๆ
ข้อกำหนดของตัวอย่าง
1. ประเภทของตัวอย่างที่ใช้ได้: สำลีเช็ดคอ สำลีเช็ดโพรงจมูก น้ำยาล้างหลอดลมและถุงลม เสมหะ
2.การเก็บตัวอย่าง (เทคนิคปลอดเชื้อ)
สำลีเช็ดคอหอย: เช็ดทอนซิลและผนังคอหอยส่วนหลังด้วยสำลี 2 อันพร้อมกัน จากนั้นจุ่มหัวสำลีในหลอดทดลองที่มีสารละลายเก็บตัวอย่าง
เสมหะ: หลังจากที่ผู้ป่วยไออย่างหนัก ให้เก็บเสมหะที่ไอออกมาในหลอดทดลองฝาเกลียวที่มีสารละลายสำหรับเก็บตัวอย่าง น้ำยาล้างหลอดลมและถุงลม: เก็บตัวอย่างโดยแพทย์ผู้เชี่ยวชาญ 3. การจัดเก็บและขนส่งตัวอย่าง
ตัวอย่างสำหรับการแยกไวรัสและการทดสอบ RNA ควรได้รับการทดสอบโดยเร็วที่สุด ตัวอย่างที่ตรวจพบได้ภายใน 24 ชั่วโมงสามารถเก็บไว้ที่อุณหภูมิ 4℃ ส่วนตัวอย่างที่ตรวจพบไม่ได้ภายใน 24 ชั่วโมง
ชั่วโมงควรเก็บไว้ที่อุณหภูมิ -70℃ หรือต่ำกว่า (หากไม่มีสภาวะการเก็บรักษาที่ -70℃ ควรเก็บไว้
ควรเก็บตัวอย่างชั่วคราวที่อุณหภูมิ -20℃ ในตู้เย็น) ตัวอย่างควรหลีกเลี่ยงการแช่แข็งและละลายซ้ำๆ ระหว่างการขนส่ง ควรส่งตัวอย่างไปที่ห้องปฏิบัติการโดยเร็วที่สุดหลังจากเก็บตัวอย่าง หากจำเป็นต้องขนส่งตัวอย่างในระยะทางไกล ขอแนะนำให้จัดเก็บด้วยน้ำแข็งแห้ง
วิธีการทดสอบ
1. การประมวลผลตัวอย่างและการสกัด RNA (พื้นที่การประมวลผลตัวอย่าง)
ขอแนะนำให้นำตัวอย่างของเหลว 200 μl สำหรับการสกัด RNA สำหรับขั้นตอนการสกัดที่เกี่ยวข้อง โปรดดูคำแนะนำของชุดสกัด RNA เชิงพาณิชย์ ทั้งตัวอย่างที่เป็นลบและลบ
การควบคุมในชุดนี้เกี่ยวข้องกับการสกัด
2. การเตรียมรีเอเจนต์ PCR (บริเวณเตรียมรีเอเจนต์)
2.1 นำส่วนประกอบทั้งหมดออกจากชุดอุปกรณ์ ละลายน้ำแข็งและผสมที่อุณหภูมิห้อง ปั่นเหวี่ยงที่ความเร็ว 8,000 รอบต่อนาทีเป็นเวลาสองสามวินาทีก่อนใช้งาน คำนวณปริมาณสารเคมีที่ต้องการ จากนั้นระบบปฏิกิริยาจะพร้อมตามที่แสดงในตารางต่อไปนี้:
| ส่วนประกอบ | N เสิร์ฟ (ระบบ 25µl) |
| โพรบ nCOV ไพรเมอร์ TaqMan | 18 µl × N |
| สารละลายปฏิกิริยา RT-PCR | 2 µl × N |
| *N = จำนวนตัวอย่างที่ทดสอบ + 1 (ควบคุมเชิงลบ) + 1 (nCOVการควบคุมเชิงบวก) | |
2.2 หลังจากผสมส่วนประกอบต่างๆ ให้เข้ากันแล้ว ให้ปั่นเหวี่ยงเป็นเวลาสั้นๆ เพื่อให้ของเหลวทั้งหมดบนผนังหลอดตกลงไปที่ก้นหลอด แล้วแบ่งระบบขยายเสียงปริมาตร 20 µl ลงในหลอด PCR
3. การสุ่มตัวอย่าง (พื้นที่เตรียมตัวอย่าง)
เติมสารควบคุมเชิงลบและเชิงบวก 5 μl หลังจากการสกัด เติม RNA ของตัวอย่างที่ต้องการทดสอบลงในหลอดปฏิกิริยา PCR
ปิดฝาหลอดให้แน่นแล้วปั่นที่ 8,000 รอบต่อนาทีเป็นเวลาสองสามวินาทีก่อนจะถ่ายโอนไปยังพื้นที่ตรวจจับการขยาย
4. การขยาย PCR (พื้นที่ตรวจจับที่ขยาย)
4.1 วางหลอดปฏิกิริยาไว้ในเซลล์ตัวอย่างของเครื่องมือ และตั้งค่าพารามิเตอร์ดังต่อไปนี้:
| เวที | วงจร ตัวเลข | อุณหภูมิ(°ซ) | เวลา | ของสะสมเว็บไซต์ |
| ย้อนกลับการถอดความ | 1 | 42 | 10นาที | - |
| ก่อนการเปลี่ยนแปลงสภาพธรรมชาติn | 1 | 95 | 1นาที | - |
| วงจร | 45 | 95 | 15วินาที | - |
| 60 | 30 วินาที | การรวบรวมข้อมูล |
การเลือกช่องตรวจจับเครื่องมือ: เลือกช่อง FAM、HEX、CY5 สำหรับสัญญาณฟลูออเรสเซนต์ สำหรับการอ้างอิง ฟลูออเรสเซนต์ NONE โปรดอย่าเลือก ROX
5. การวิเคราะห์ผล (โปรดดูคำแนะนำการทดลองของแต่ละเครื่องมือเพื่อการตั้งค่า)
หลังจากปฏิกิริยา ให้บันทึกผลลัพธ์ หลังจากวิเคราะห์ ให้ปรับค่าเริ่มต้น ค่าสิ้นสุด และค่าขีดจำกัดของเส้นฐานตามภาพ (ผู้ใช้สามารถปรับตามสถานการณ์จริง โดยค่าเริ่มต้นสามารถตั้งค่าเป็น 3~15 และค่าสิ้นสุดสามารถตั้งค่าเป็น 5~20 การปรับ) ในกราฟลอการิทึม ที่ขีดจำกัดของหน้าต่าง เส้นขีดจำกัดจะอยู่ในเฟสลอการิทึม และเส้นโค้งการขยายของการควบคุมเชิงลบจะเป็นเส้นตรงหรือต่ำกว่าเส้นขีดจำกัด)
6 การควบคุมคุณภาพ (การควบคุมตามขั้นตอนรวมอยู่ในการทดสอบ) การควบคุมเชิงลบ: ไม่มีเส้นโค้งการขยายสัญญาณที่ชัดเจนสำหรับช่องตรวจจับ FAM, HEX, CY5
การควบคุม COV เชิงบวก: เส้นโค้งการขยายที่ชัดเจนของช่องตรวจจับ FAM และ HEX ค่า Ct ≤32 แต่ไม่มีเส้นโค้งการขยายของช่อง CY5
ต้องปฏิบัติตามข้อกำหนดข้างต้นพร้อมกันในการทดลองเดียวกัน มิฉะนั้น การทดลองจะถือเป็นโมฆะและจะต้องทำซ้ำ
7. การกำหนดผลลัพธ์
7.1 หากไม่มีเส้นโค้งการขยายหรือค่า Ct> 40 ในช่อง FAM และ HEX ของตัวอย่างทดสอบ และมีเส้นโค้งการขยายในช่อง CY5 สามารถตัดสินได้ว่าไม่มี RNA ของไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (2019-nCoV) ในตัวอย่าง
.2 หากตัวอย่างทดสอบมีเส้นโค้งการขยายที่ชัดเจนในช่อง FAM และ HEX และค่า Ct อยู่ที่ ≤40 สามารถตัดสินได้ว่าตัวอย่างเป็นผลบวกสำหรับไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (2019-nCoV)
7.3 หากตัวอย่างทดสอบมีเส้นโค้งการขยายที่ชัดเจนในช่องเดียวของ FAM หรือ HEX และค่า Ct อยู่ที่ ≤40 และไม่มีเส้นโค้งการขยายในช่องอื่น ผลลัพธ์จะต้องได้รับการทดสอบซ้ำ หากผลการทดสอบซ้ำสอดคล้องกัน สามารถตัดสินได้ว่าตัวอย่างเป็นบวกสำหรับการทดสอบซ้ำ
เชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (2019-nCoV) หากผลการตรวจซ้ำเป็นลบ ก็สามารถวินิจฉัยได้ว่าตัวอย่างเป็นลบสำหรับเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (2019-nCoV)
ค่าการตัดสินเชิงบวก
ใช้วิธีการโค้ง ROC เพื่อกำหนดค่า CT อ้างอิงของชุด และค่าอ้างอิงการควบคุมภายในคือ 40
การตีความผลการทดสอบ
1. ควรทดสอบการควบคุมเชิงลบและเชิงบวกในการทดลองแต่ละครั้ง ผลการทดสอบจะระบุได้เมื่อการควบคุมเป็นไปตามข้อกำหนดการควบคุมคุณภาพเท่านั้น
2. เมื่อช่องตรวจจับ FAM และ HEX เป็นบวก ผลลัพธ์จากช่อง CY5 (ช่องควบคุมภายใน) อาจเป็นลบเนื่องจากการแข่งขันของระบบ
3. เมื่อผลการควบคุมภายในเป็นลบ หากช่องตรวจจับ FAM และ HEX ของหลอดทดลองเป็นลบด้วย แสดงว่าระบบถูกปิดใช้งานหรือการทำงานไม่ถูกต้อง การทดสอบนั้นไม่ถูกต้อง ดังนั้นจำเป็นต้องทดสอบตัวอย่างอีกครั้ง